1. Morfología
2. Ciclo de vida
3. Funciones
- Digestión
- Protección
Los enterocitos son células columnares que forman la mayor parte del epitelio prismático simple de la mucosa del intestino (Figuras 1 y 2). Son más abundantes en el epitelio del intestino delgado que en el del grueso y del apéndice. En el intestino delgado pueden llegar a ser hasta el 80 % de todas las células del epitelio intestinal. Su principal misión es la absorción de sustancias nutritivas desde la luz del intestino y su transporte al interior del cuerpo. Hay que tener en cuenta que el epitelio intestinal es la mayor superficie del cuerpo en contacto con el medio exterior, mayor que la piel.
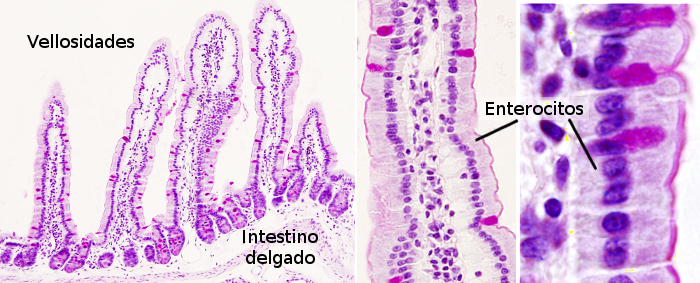

1. Morfología
Los enterocitos poseen microvellosidades en su parte apical (Figura 3), numerosas mitocondrias en su base, y un retículo endoplasmático y un aparato de Golgi muy desarrollados. La integridad del epitelio, es decir, que los enterocitos se mantengan unidos entre sí formando una capa celular sellada, sin dejar espacios intercelulares, depende de los complejos de unión que se establecen entre enterocitos contiguos (Figura 4). Hay uniones estrechas y uniones adherentes próximas a la superficie apical de la célula. Las membranas laterales de los enterocitos interaccionan entre sí sobre todo mediante desmosomas y algunas uniones en hendidura. En sus membranas basales se encuentran los hemidesmosomas, los cuales mantienen los enterocitos unidos a la lámina basal.
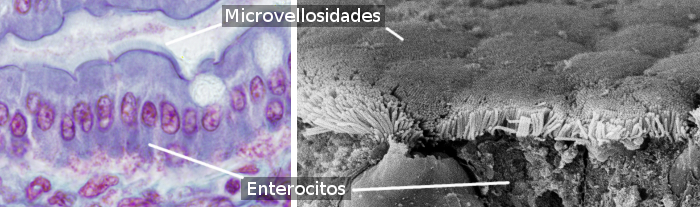

Los enterocitos poseen dominios celulares diferenciados, uno apical y otro basolateral (Figura 4). Por ello se dice que son células polarizadas. La polaridad se produce gracias a un citoesqueleto bien orientado y a un tráfico vesicular muy desarrollado que distribuye elementos y moléculas de manera desigual entre los dominios apical y basolateral, respectivamente. Las uniones estrechas impiden difusiones laterales de las moléculas de membrana entre estos dos dominios, permitiendo el mantenimiento de la polaridad. Los enterocitos presentan en su superficie apical una gran cantidad de microvellosidades densamente dispuestas formando lo que se denomina ribete en cepillo, lo que aumenta la superficie apical de la célula hasta 100 veces (Figura 3). En estas membranas apicales se encuentran los transportadores necesarios para la incorporación de moléculas que resultan de la digestión, mientras que en las membranas basolaterales se encuentran los transportadores necesarios para sacar del enterocito estas moléculas incorporadas que tienen que pasar al torrente sanguíneo. Esta distribución desigual está mediada por un tráfico vesicular especial.
2. Ciclo de vida
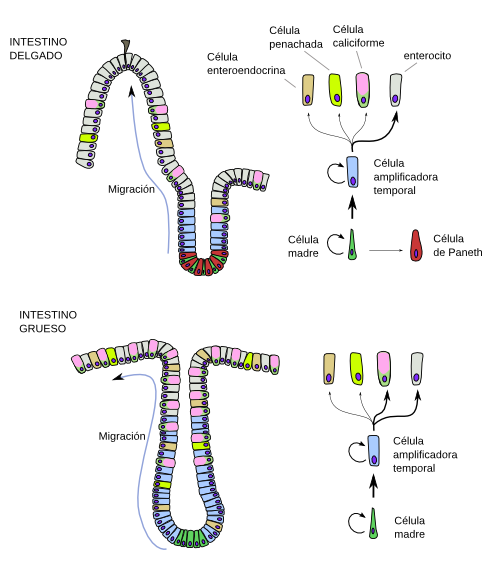
Los enterocitos están en contacto con sustancias tóxicas y sufren daños continuos. En vez de repararse, son renovados constantemente mediante una alta producción de nuevos enterocitos y por la eliminación mediante extrusión desde la capa epitelial o por muerte por apoptosis los más viejos y dañados. La mucosa intestinal presenta numerosos pliegues que en el intestino delgado forman las vellosidades intestinales y las criptas de Lieberkün, mientras que en el intestino grueso se forman sólo criptas. El ciclo de vida de un enterocito comienza en las profundidades de la cripta y termina en la superficie de las vellosidades del intestino delgado o en la superficie epitelial del intestino grueso. Un enterocito del intestino delgado de un ratón tarda unos 2 a 5 días desde que se produce la división de la células madre de la cripta hasta que alcanza el pico de una vellosidad. En humanos el epitelio intestinal es renovado completamente cada 4 o 5 días.
Los enterocitos se forman a partir de las células madre residentes en las criptas (Figura 5). Inicialmente estas células madre se dividen y dar lugar las células progenitoras transitorias, las cuales se sitúan un poco más alejadas de la profundidad de la cripta, y se dividirán rápidamente unas 4 a 6 veces. Después cesarán las divisiones y se irán diferenciando progresivamente en los diferentes tipos de células del epitelio: las células caliciformes, células M, etcétera, pero la mayoría de ellas lo harán en enterocitos. Los enterocitos diferenciados se irán deslizando y siendo empujados por nuevas células hasta la superficie de las vellosidades o superficie epitelial. Una vez alcanzan esta posición son mayoritariamente extruidos. Esto se produce por presión mecánica y por pérdida de las conexiones adherentes con sus células vecinas. Algunas células, sin embargo, comienzan procesos apoptóticos que le llevarán a la muerte celular y su expulsión del epitelio. No se sabe qué es lo que mueve a estas células en su camino hacia su localización final pero parece que los componentes de la lámina basal sobre la que descansan, los cuales son diferentes en la zona de las criptas respecto a otras más superficiales, pueden contribuir a su desplazamiento. Se ha comprobado que la dinámica de la vida de los enterocitos está influida por el tipo de dieta.
3. Funciones
Digestión
La principal función de los enterocitos es la de absorber nutrientes que provienen de la degradación estomacal y enzimática. Sin embargo, los enterocitos usan sobre todo glutamato y glutamina para sus propias necesidades energéticas, aunque pueden usar glucosa y ácidos grasos también. Esto es curioso puesto que por ellos pasan todos lo nutrientes del organismo. Los enterocitos también realizan digestión mediante la secreción de enzimas propios que degradan péptidos y disacáridos. El glicocálix de la membrana apical de los enterocitos forma una capa de 400 a 500 nanometros de espesor, a veces hasta 1 µm. Algunos de los enzimas digestivos del intestino se encuentran anclados a la membrana de los enterocitos, y a su glicocálix. Así, los enterocitos no sólo perimiten la selección e incorporación de sustancias, también procesan muchas de ellas. De hecho se habla de dos fases de la digestión, una que ocurre en el espacio interior del tubo digestivo alejado de las paredes epiteliales llevado a cabo fundamentalmente por enzimas pancreáticas, y otra realizada por las enzimas asociadas a la superficie de los enterocitos. La mayor absorción de alimentos la realizan los enterocitos del intestino delgado, mientras que los del intestino grueso absorben principalmente agua. Además, desde el extremo de estas microvellosidades se liberan pequeñas vesículas hacia la luz del conducto. Estas vesículas pueden tener enzimas, sobre todo fosfatasas, que podrían tener un carácter protector frente a patógenos.
Las sustancias degradadas en el tubo digestivo han de pasar la barrera del epitelio intestinal para llegar a la sangre. Esto puede ocurrir de varias maneras: por vía transcelular, por endocitosis / transcitosis y por vía paracelular.
Transcelular. La mayoría de las moléculas nutritivas que se encuentran en la luz del tubo digestivo atraviesan el epitelio a través de los enterocitos cruzando sus membranas, primero la apical y luego las basolaterales. El transporte puede ser pasivo, bien por difusión libre o facilitada, o activo. En el primer caso, difusión libre, las moléculas cruzan libremente la membrana a favor de gradiente de concentración, mientras que en los dos últimos, difusión facilitada y transporte activo, lo hacen mediados por proteínas transmembrana denominadas transportadoras. Por difusión libre entran el agua, etanol y muchos lípidos, y por difusión facilitada o por transporte activo entran la glucosa, lípidos, algunos aminoácidos, y di- y tri-péptidos.
La parte apical de la célula, la zona que forma la superficie libre, tiene un juego de moléculas que permite la absorción de sustancias, mientras que la membranas laterales y basales tienen otro conjunto de moléculas que permiten el transporte de moléculas desde el interior del enterocito al medio extracelular.
La capacidad de absorción depende del grado de diferenciación del enterocito, lo cual influye en la cantidad de bombas de sodio, y éstas son más abundantes conforme más alejado está el enterocito del fondo de las criptas de Lieberkühn donde se originó. Por tanto, la mayor parte de la absorción de azúcares y aminoácidos se produce en el tercio superior de la vellosidad intestinal del intestino delgado y en las proximidades de la superficie epitelial del intestino grueso. Por ejemplo, la actividad hidrolasa aumenta a medida que el enterocito se va alejando de la zona profunda de la cripta.
Un mecanismo de absorción típico es el de la glucosa, la cual entra en el enterocito desde la luz del digestivo mediante un cotransporte de tipo simporte acoplado a un gradiente de sodio creado en la membrana del enterocito por bombas sodio/potasio. Este gradiente de sodio permite incorporar glucosa en contra del gradiente de concentración de la propia glucosa. La molécula de membrana que permite este cotransporte se denomina SGLT1 (sodium glucose transporter), el cual incorpora una molécula de glucosa por cada dos iones de sodio que salen. Por otra parte, en la membrana basolateral se encuentra sobre todo el tranportador GLUT2, el cual es transportador bidireccional y transloca glucosa entre ambos lados de la membrana siempre a favor de gradiente de concentración. Así, SGLT1 aumenta la concentración intracelular de glucosa en el enterocito y GLUT2 la saca hacia el torrente sanguíneo. Es la disposición polarizada de estos dos transportadores lo que produce el flujo de glucosa a través de los enterocitos.
La grasa es una de las sustancias ingeridas más energéticas, además de ser fundamental para las propias membranas celulares. La mayoría de estas grasas que se ingieren son triacilglicéridos, aunque hay otros importantes como el colesterol. Los enterocitos los incorporan por el siguiente mecanismo (Figura 6). Primero hay una degradación en el interior del intestino por la lipasas pancreáticas. Los triacilgliceroles se descomponen en ácidos grasos y monoacilgliceroles. Éstos, junto con el colesterol, las vitaminas solubles en grasas y los fosfolípidos forman micelas, que son pequeñas gotas de grasa que se solubilizan en agua gracias a la acción de las sales biliares. Las micelas atraviesan libremente la membrana del enterocito. Pero también hay transportadores de sustancias grasas como los denominados CD36 y FABP (fatty acid binding protein) que permiten la incorporación facilitada de lípidos a través de la membrana. El mecanismo pasivo parece ser la principal vía de incorporación de lípidos, mientras que la incorporación mediada por transportador parece ser una forma de sentir la presencia de los lípidos de cadena larga en el intestino. Para el caso del colesterol, como molécula individual, los enterocitos expresan en su dominio apical el translocador NPC1L1 (Niemann-Pick C1-like 1), el cual traslada el colesterol desde el exterior al interior del enterocito.

Una vez dentro del enterocito, las grasas se unen a proteínas y son dirigidas al retículo endoplasmático donde se sintetizan de nuevo triacilglicéridos. En este orgánulo se combinan con proteínas para formar lipoproteínas llamadas pre-quilomicrones. En el retículo endoplasmático rugoso se sintetiza una proteína denominada ApoB, la cual, con ayuda de la proteína MTP (microsome tranfer protein), se une a ácidos grasos formando esta partícula primordial lipoproteica. Mientras, en el retículo endoplasmático liso la proteína MTP también ayuda a crear partículas que no tienen ApoB, pero sí la proteína apoA-IV. La absorción de grasas estimula la producción de apoliproteína A-IV, que formarán la superficie de los pre-quilomicrones. La propia Apo A-IV es un inhibidor del hambre. Todos estos componentes se agregan en el retículo endoplasmático liso y forman los pre-quilomicrones. Éstos se empaquetan en vesículas y viajan hasta el aparato de Golgi. En el aparato de Golgi los pre-quilomicrones se fusionan para formar quilomicrones, los cuales son empaquetados en vesículas que serán exocitadas en las membranas baso-laterales del enterocito. Los quilomicrones son lipoproteínas ricas en triacilglicéridos con un cuerpo central y una capa de fosfolípidos, colesterol y apolipoproteínas. Juegan un papel importante en el transporte de triacilglicéridos y vitaminas liposolubles. Además de en quilomicrones, las grasas también se empaquetan en lipoproteínas de muy baja densidad (VLDL), que son exocitadas, o se almacenan de forma temporal en el citoplasma de los enterocitos en forma de gotas de lípidos.
Ya fuera del enterocito, los quilomicrones entran en los vasos linfáticos que corren por el centro de la vellosidad intestinal y entran en el plexo mierentérico linfático, desde el cual pasarán al torrente sanguíneo.
El enterocito es el encargado de incorporar el hierro de la dieta. Este metal es importante para numerosas proteínas incluida la hemoglobina. El hierro de la dieta puede encontrarse formando parte de grupos hemo o unido a ferritina (en alimentos de origen animal) (Figura 7). El hierro libre producido durante la digestión se incorpora a los enterocitos entrando a través del transportador de membrana DMT1 (transportador de metales bivalentes). Los ratones a los que se les elimina este transportador desarrollan anemias severas. DMT1 es un co-transportador acoplado a un gradiente de protones. El gradiente de protones está generado por las bombas de Na+/H+ que se encuentran en las membranas apicales de los enterocitos. DMT1 sólo transporta Fe2+ pero la mayoría del hierro de la dieta es Fe3+. Esta reducción se lleva a cabo por una enzima reductasa localizada en la superficie apical del enterocito. Por otro lado, el hierro unido a grupos hemo parece incorporarse por endocitosis mediada por receptor. Una vez dentro del enterocito, el grupo hemo es degradado y el hierro sacado al citoplasma.

Cualquiera que sea la vía de entrada, una vez en el citosol, el viaje del hierro hasta las membranas basolaterales parece mediado por una familia de metalochaperonas. El hierro se saca del enterocito a través de las membranas basolaterales gracias a un transportador conocido como ferroportina. La ferroportina sólo saca Fe2+ mientras que la transferrina que llevará al hierro en la sangre del sistema porta transporta Fe3+. En la membrana hay ferro-oxidasas que hacen esta conversión. Dentro del enterocito se puede mantener y almacenar hierro uniéndose a ferritina.
Proteínas. Las proteínas es uno de los tres macronutrientes, junto con las grasas y los carbohidratos. Las proteínas se usan sobre todo para la obtención de aminoácidos para producir nuevas proteínas, y sólo las que se consumen en exceso se usan como fuente de energía. La disgestión de las proteínas requiere de la participación de encimas como las pepsinas, las peptidasas pancreácticas y las peptidasas que se encuentran en la superficie apical de los enterocitos. La absorción de amnioácidos ocurre gracias a la presencia de transportadores de membrana presentes en los enterocitos. Hay distintos tipos de transportadores para cada grupo de aminoácidos. Para el caso de los aminoácidos neutros, la entrada en el enterocito está mediada por un gradiente de sodio en transporte de tipo cotransporte simporte. Sin embargo, la salida de los aminoácidos por las membranas basolaterales por transporte simple pasivo facilitado mediado por otro tipo de transportadores, de los cuales hay varios incluso para el mismo tipo de aminoácidos (hasta 4 para sacar a los aminoácidos neutros de los enterocitos). En el caso de los aminoácidos catiónicos, hay un mecanismos de cotransporte antiporte en ambas membranas, que son independientes de sodio, pero dependientes de aminoácidos neutros. Para los aminoácidos aniónicos hay un cotransporte de tipo antiporte asociado a iones sodio, hidrógeno y potasio.
Entrada por endocitosis /transcitosis. Moléculas como ciertas inmunoglobulinas son endocitadas por los enterocitos mediante endocitosis mediada por receptor y posterior transcitosis. Inicialmente las vesículas se forman en la base de las microvellosidades y se fusionan con los endosomas. Desde los endosomas se liberan vesículas que se fusionarán con las membranas basales y laterales. De esta manera las moléculas transportadas no entran en contacto con el citosol ni son derivadas a los lisosomas.
Paracelular. Por vía paracelular entran moléculas como el agua e iones como el calcio.
Protección
Los enterocitos han de formar una barrera que permita el paso de sustancias nutritivas pero impida la entrada de antígenos, moléculas tóxicas o microbios. Durante el proceso de absorción de alimentos los enterocitos se exponen a una gran cantidad de microbios, no sólo a los que están presentes de forma natural en el tubo digestivo, los cuales pueden ser perjudiciales si entran en los tejidos, sino también a otros patógenos no residentes. Tienen que absorber alimentos pero evitar los patógenos. La superficie apical de los enterocitos está recubierta por mucus liberado por las células caliciformes. Este mucus está formado por glúcidos y crea un recubrimiento con una densidad que permite el paso de las moléculas alimenticias pero lo impide a moléculas grandes o patógenos. Además, el ribete en cepillo de microvellosidades forman una barrera anti-patógenos porque en sus ápices poseen un glicocálix muy desarrollado con una gran cantidad de cargas negativas que dificulta el contacto directo de los patógenos con la membrana de la célula. Pero incluso, aunque pasen esa barrera aún tendrán que vérselas con el sistema de transporte de la propia microvellosidad.
En la membrana de la superficie apical de los entereocitos se localizan las proteínas denominadas mucinas, que están muy glicosiladas y contribuyen a crear el glicocálix tan desarrollado que prensentan estas células. Son proteínas transmembrana unidas por el dominio citosólico al citoesqueleto. Las más abundantes son las mucinas MUC3, MUC12 y MUC17. Tienen unos 5000 aminoácidos y con glúcidos que se extienden extracelularmente hasta 1 µm. Las mucinas crean una barrera difícil de traspasar por las bacterias.
Los enterocitos son capaces de iniciar y regular procesos inflamatorios puesto que pueden liberar numerosas citocinas y quimiocinas, además de tener receptores para ellas. Así, secretan moléculas proinflamatorias que actúan sobre las células inmunitarias que se encuentran en la mucosa intestinal.
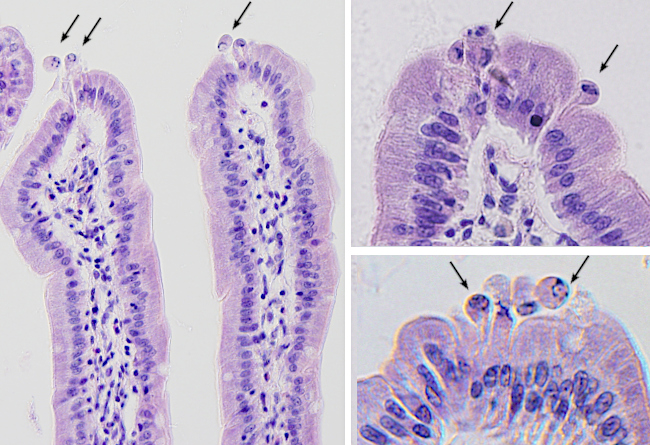
Otro sistema de protección menos conocido es la liberación de vesículas desde la superficie apical del enterocito. El aparato motor de actina y miosina, que existe en las microvellosidades del enterocito, produce fuerzas de arrastre en las membrana de la microvellosidad provocando acumulación de membrana en su parte apical. Esta acumulación provoca la formación y liberación de vesículas al interior de tubo digestivo. Estas vesículas contienen en su interior un alta proporción de fosfatasa alcalina, la cual es una potente defensora frente a patógenos ya que reduce la toxicidad de los lipopolisacáridos y otros componentes bacterianos, además de reducir la inflamación intestinal. También disminuye la unión de las bacterias a las células epiteliales intestinales e inhibe el crecimiento bacteriano. Así, la emisión de estas vesículas es una manera de enviar una molécula antimicrobiana a zonas alejadas de la propia membrana del enterocito.
-
Bibliografía ↷
-
Barker N. 2014. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration. Nature. 15: 19-33.
Bröer S. 2023. Intestinal amino acid transport and metabolic health. Annual review of nutrition. 43:73-99. https://doi.org/10.1146/annurev-nutr-061121-094344
Giammanco A, Cefalù AB, Noto D, Averna MR. 2015. The pathophysiology of intestinal lipoprotein production. Frontiers in physiology. 6: 61.
Knutson MD. 2017. Iron transport proteins: gateways of cellular and systemic iron homeostasis. Journal of biological chemistry Nature review in molecular cell biology. 292: 12735-12743.
Shifrin DA, McConell RE, Nambiar R, Higginbotham JN, Coffey RJ, Tyska MJ. 2012. Enterocyte microvillus-derived vesicles detoxify bacterial products and regulate epithelial-microbial interactions. Current biology. 22: 627-631.
Snoeck V, Goddeeries B, Cox E. 2005. The role of enterocytes in the intestinal barrier function and antigen uptake. Microbes and infection. 7: 997-1004.
-